Projekt EpiHAP: Pflanzenzüchtung beschleunigen
Wie beeinflusst die Epigenetik die Bildung doppelt-haploider Linien?
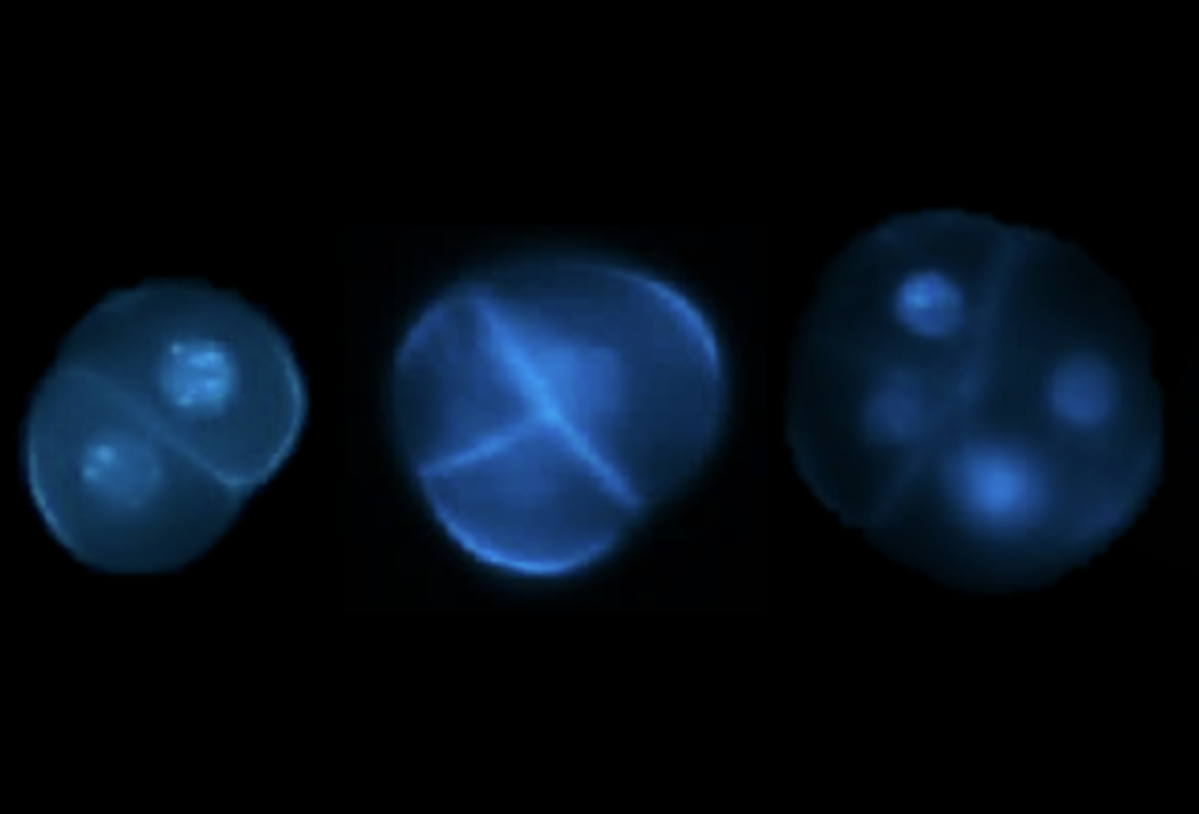
Aus haploiden Mikrosporen können sich in manchen Fällen Embryonen entwickeln. Wenn bekannt wäre, welche Gene dafür verantwortlich sind, könnte man viel einfacher doppelt-haploide Linien erzeugen und so die Züchtung beschleunigen. (Bildquelle: © Dr. Dema A
Doppelt-haploide Zuchtlinien sind ein unverzichtbares Werkzeug für Pflanzenzüchter. Doch ihre Herstellung ist schwierig und gelingt nur bei einigen Arten. EpiHAP untersucht, ob dafür die Epigenetik verantwortlich ist. Das soll die Erzeugung doppelt-haploider Linien zukünftig effizienter machen.
Pflanzenzüchter stehen zurzeit in einem Wettlauf mit dem Klimawandel: Sie müssen schneller Sorten erzeugen, die auch noch bei steigenden Temperaturen, Extremwetterereignissen und sich ausbreitenden Krankheiten und Schädlinge gute Erträge bringen.
Vorteile von doppelt-haploide (DH) Linien in der Züchtung
- Kreuzt man sie, so erben die Nachkommen von ihnen immer das gleiche Allel. Gewünschte Eigenschaften können daher in der folgenden Generation nicht verloren gehen.
- Die genetische Homogenität ist besonders vorteilhaft für die reproduzierbare Bewertung von Phänotypen und die präzise Selektion von erwünschten Eigenschaften. Es erleichtert auch die Produktion von Saatgut mit konstanten und vorhersehbaren Eigenschaften.
- Aufgrund der Homozygotie können rezessive Allele leichter identifiziert und selektiert werden. Das ist besonders nützlich, wenn eine bestimmte Krankheitsresistenz oder andere wünschenswerte Merkmale, die durch rezessive Gene kontrolliert werden, selektiert werden sollen.
- Mit DH-Linien können leistungsstarke Hybridsorten erzeugt werden.
- Die Homozygotie und genetische Stabilität von DH-Linien machen sie auch zu einem idealen Werkzeug für molekulare Züchtungsansätze, einschließlich Marker-gestützter Selektion (MAS) und Genom-Editierung. Das erleichtert die präzise Integration von neuen Eigenschaften und die Entwicklung von Sorten mit spezifischen Merkmalskombinationen.
Ein unverzichtbares Werkzeug dafür sind sogenannte doppelt-haploide (DH) Linien. Herkömmliche Pflanzen verfügen in ihren Zellkernen in der Regel über unterschiedliche Ausprägungen eines Gens (Allele), weil eine Kopie von der Mutter und eine vom Vater stammt. DH-Linien hingegen sind komplett reinerbig: alle Chromosomen enthalten identische Allele (Homozygotie). Das beschleunigt die Züchtung in vielerlei Hinsicht (siehe Kasten links).
Doch um DH-Linien konventionell herzustellen, muss man eine Pflanze über viele Generationen immer wieder mit sich selbst bestäuben bzw. befruchten (Erzeugung von Inzuchtlinien, siehe Foto unten). Das kostet Züchter:innen viel Zeit: mindestens sechs bis acht Jahre bei einjährigen Pflanzen wie den Getreiden. Bei mehrjährigen Pflanzen wie Obstbäumen oder Reben kann das sogar Jahrzehnte in Anspruch nehmen.
Wesentlich schneller geht es, wenn man ein wenig nachhilft. Dafür nutzt man unreifen Pollen, auch Mikrosporen genannt, der haploid ist, also nur einen Chromosomensatz enthält. Diese Mikrosporen können sich unter bestimmten in vitro Kulturbedingungen zu einem Embryo und anschließend zu einer ganzen Pflanze weiterentwickeln. Die Verdoppelung des Chromosomensatzes lässt sich dann entweder mit der Chemikalie Colchizin induzieren, teilweise geschieht es aber auch spontan. So hat man in sehr kurzer Zeit eine Pflanze, die doppelt-haploid und damit komplett reinerbig ist.

Zur Herstellung von DH-Linien muss herkömmlicherweise eine Pflanze (hier Raps) über viele Generationen wiederholt mit eigenen Pollen bestäubt werden. Um Fremdbefruchtung zu vermeiden, werden die Blüten mit Kunstofftüten abgedeckt.
Bildquelle: © M. Arlt / PLANT 2030
Das Problem dabei: Bei vielen agronomisch wichtigen Arten funktioniert die Methode gar nicht oder nur in bestimmten Sorten. Außerdem ist sie sehr ineffizient. „Von Tausend Zellen bekommt man vielleicht eine, die sich dazu entscheidet, ein Embryo zu werden. Die restlichen entwickeln sich anders oder sterben ab“, erklärt Franziska Turck, die am Max-Planck-Institut für Pflanzenzüchtungsforschung in Köln die Arbeitsgruppe „Epigenetische Kontrolle der Pflanzenentwicklung“ leitet. Doch bisher rätselt die Forscherin, warum das so ist.
Die Projektpartner und das übergeordnete Ziel
- Dr. Franziska Turck, Max-Planck-Institut für Pflanzenzüchtungsforschung, Köln
- Dr. Bruno Hüttel, Max Planck Genome Centre Cologne, Köln
- Prof. Dr. Klaus Palme, ScreenSYS, Freiburg
Das Ziel von EpiHAP ist es herauszufinden, warum manche Mikrosporen sich nach einer Induktion durch Hitzestress zu einem Embryo weiterentwickeln und andere nicht. „Es wäre natürlich denkbar, dass es reiner Zufall ist, aber das wäre langweilig für unsere Analysen“, scherzt Franziska Turck. Sie nimmt an, dass es in manchen Zellen bereits vor der Hitzebehandlung epigenetische Ausprägungen gibt, die bestimmen, ob die Zelle absterben wird oder sich zu einem Embryo entwickelt.
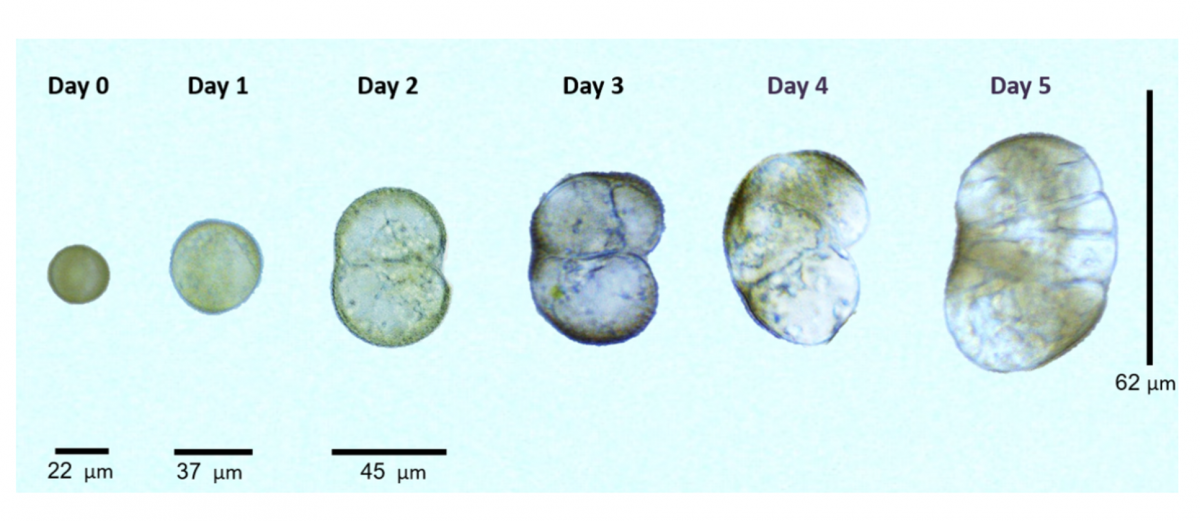
Entwickelnde doppelt-haploide Embryonen in Kultur. Tag 1 entspricht dem Moment der Entnahme. Bis zu Tag 3 werden die Kulturen durch Hitzestress induziert. Die Stadien sind exemplarisch an verschiedenen Zeitpunkten entnommen.
Bildquelle: © Dr. Dema Alhajturki
Epigenetische Veränderungen sind chemische Modifikationen an der DNA oder den Histonen (den Proteinen, um die die DNA gewickelt ist), die, ohne die DNA-Sequenz selbst zu verändern, die Genexpression beeinflussen können. Solche epigenetischen Modifikationen können die Zugänglichkeit der Gene für Transkriptionsfaktoren und andere zelluläre Maschinerien ändern, indem sie die DNA dichter packen (und Gene abschalten) oder lockerer machen (und Gene einschalten). So könnten epigenetische Unterschiede zwischen individuellen Zellen auch bestimmen, ob deren Gene für eine erfolgreiche Embryogenese aktiv werden oder nicht.
Wenn man wüsste, welche Gene für eine erfolgreiche Embryogenese verantwortlich sind und ob sie durch epigenetische Markierungen an- oder abgeschaltet werden, wäre man einen sehr großen Schritt weiter. Dann könnte man versuchen, durch veränderte Kulturbedingungen oder Wirkstoffe den epigenetischen Zustand zu verändern, um diese Technik in Arten zugänglich zu machen, wo sie bisher nicht oder nicht so gut funktioniert.
Das Vorgehen
Als Versuchspflanze dient Raps (Brassica napus), weil hier – zumindest bei einigen Linien – die Erzeugung von DH-Linien bereits gut etabliert ist. Aus den unreifen Blüten entnehmen die Mitarbeiter der Arbeitsgruppe von Franziska Turck Mikrosporen, die sie anschließend für 2-3 Tage Hitzestress aussetzen. Anschließend kommen die Mikrosporen in eine nährstoffreiche Flüssigkeit, wo sie sich teilen können. Nach einer Woche sieht man die ersten Embryonen, aber die meisten bilden sich später. Je nach Spezies kann es auch zwei bis drei Wochen dauern. Solche Mikrosporen werden induzierbare Mikrosporen genannt. Die anderen entsprechend als nicht-induzierbare Mikrosporen.

Kerne von Mikrosporen im Singleron Chip, jede Position ist ein abgeschlossenes Reaktionsgefäss, in dem Transkripte für die Hochdurchsatzsequenzierung hergestellt werden.
Bildquelle: © Dr. Cristina Alcaide
Dann vergleichen Franziska Turck und ihr Team mit Einzelzellanalysen mit Hilfe von Singleron ChIPs die Unterschiede zwischen Tausenden von induzierbaren und nicht-induzierbaren Mikrosporen. Solche „Massentestungen“ von Einzelzellen mit Hilfe automatisierter Hochdurchsatzverfahren sind notwendig, um die kleine Gruppe der induzierbaren Mikrosporen von dem Löwenanteil der anderen zu unterscheiden. Das Screening der Zellen erfolgt dabei auf drei Ebenen: Genaktivitäten, epigenetische Muster und mikroskopische Erfassung der Zellmorphologie. Das passiert auch noch in unterschiedlichen Entwicklungsstadien: direkt nach der Entnahme aus der unreifen Rapsblüte sowie einen Tag und drei Tage nach dem Hitzestress. Die Hochdurchsatzanalyses werden am Max Planck Genome Centre Cologne unter der Anleitung des Projektpartners Bruno Hüttel durchgeführt.
„Wir versuchen nach Zelltypen zu clustern, die bei vergleichbaren Genexpressionsmustern sich auch ähnlich entwickeln - also schnell, langsamer oder überhaupt keine Embryogenese durchlaufen“, erklärt Franziska Turck. Damit könne man die Gene eingrenzen, die für die Embryogenese notwendig sind oder diese verhindern.
Parallel dazu erhält Kooperationspartner ScreenSYS GmbH aufgereinigtes Mikrosporen-Material und fotografiert die Zellen über 12 Tage hinweg. Anschließend kommt eine KI-basierte Bildanalyse-Methode zum Einsatz, die nach feinsten Unterschieden in den Bildern sucht und mikroskopisch kleine Bewegungen wahrnimmt. Ähnlich wie eine Gesichtserkennungssoftware soll diese KI erkennen, ob sich die Mikrosporen zu einem Embryo weiterentwickeln werden oder nicht. „Je früher man das weiß, desto schneller kann man testen, ob bestimmte Veränderungen in den Kulturbedingungen aussichtsreich sind, um die Effizienz der Methode zu steigern“, erklärt Franziska Turck.
Ausblick
„Unsere erste Einzelzell-Analyse ist gelaufen und hat zumindest gezeigt, dass wir verschiedene Gruppen von Zellen erkennen können.“, sagt Turck. Idealerweise weiß sie bald, welche Gene für eine erfolgreiche Embryogenese an- oder abgeschaltet sein müssen und somit als „Marker“ benutzt werden können.
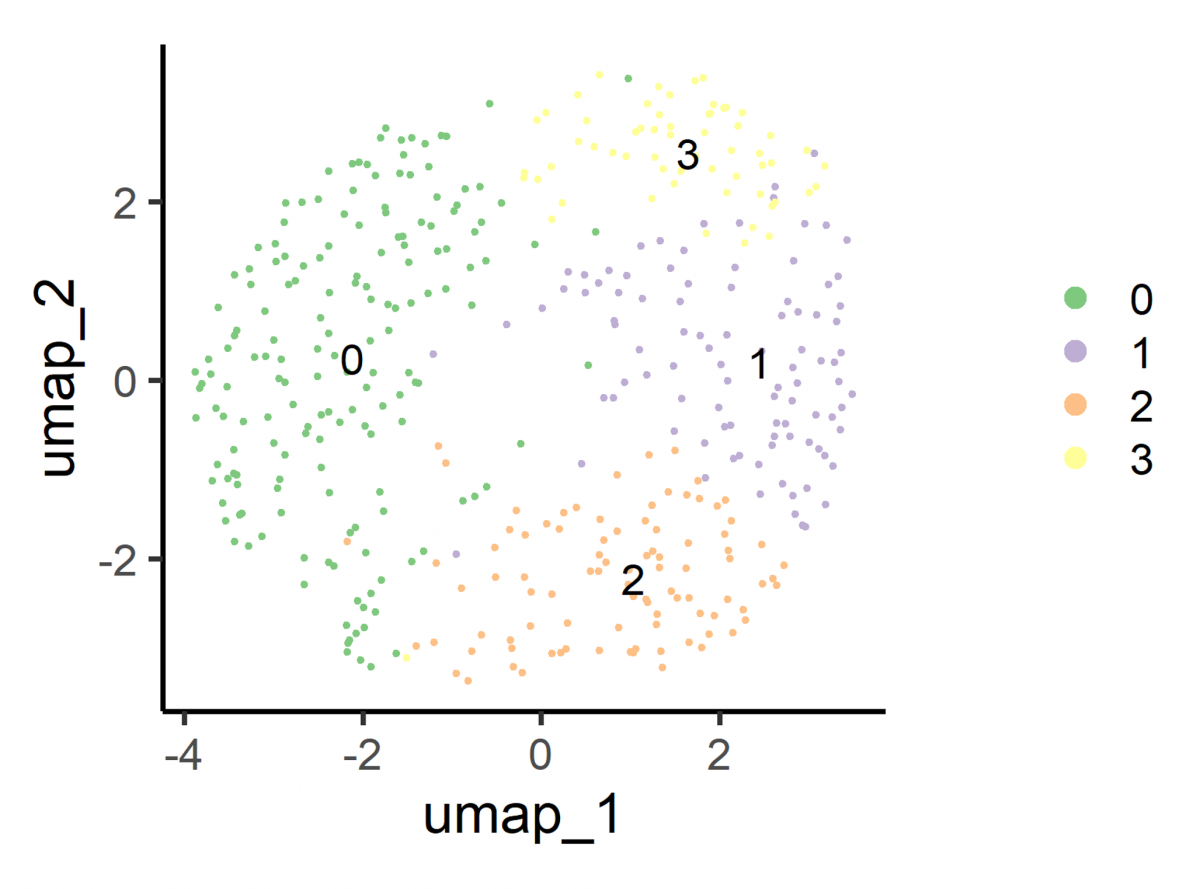
Graphische Darstellung, die die grössten Unterschiede zwischen den Kernen in zwei Dimensionen darstellt. Man erkennt vier Gruppen, die unterschiedliche Zelltypen darstellen.
Bildquelle: © Dr. Cristina Alcaide
Solche Markergene sind ein gutes Werkzeug für die schnelle Diagnostik und könnten auch gezielt manipuliert werden, um die Effizienz der Methode zu steigern.
Gern würde die Wissenschaftlerin neben Raps auch noch eine zweite Pflanze untersuchen: „Bei der Tomate ist der Prozess zurzeit extrem schwierig und es besteht ein großes Interesse daran, den Prozess auch bei dieser Pflanze zu etablieren“, erklärt Turck.
Zurzeit ist die Entwicklung von DH-Linien nur bei sehr wenigen Pflanzen möglich. Selbst bei Raps gelingt es nur bei den Linien, aus denen man gut Embryonen gewinnen kann. Dadurch verringert sich die genetische Vielfalt, auf die die Züchtung zugreifen kann.
Das Projekt EpiHAP will dazu beitragen, dass Züchter in Zukunft auf einen größeren Pool von DH-Linien zugreifen können, um daraus widerstandsfähige Pflanzen mit stabilem Ertrag zu züchten.
Zum Weiterlesen auf Pflanzenforschung.de:
- Mit einem Schlag reinerbig und genetisch stabil: die Doppelhaploiden-Technik
- Jenseits der Genetik – Das Methylom als „Hypothesen-Generator“
- Doppelhaploid-Züchtung – Projekt INPUT: Erfolgversprechende Mikrosporen für die Gewebekultur erkennen
Titelbild: Welche Mikrosporen bilden Embryonen? Wenn dies bekannt wäre, könnte man viel einfacher doppelt-haploide Linien erzeugen und so die Züchtung beschleunigen. (Bildquelle: © Dr. Dema Alhajturki)
