„Die Chemie der Natur ist unsere Inspiration“
Interview mit Benedikt Seligmann

Der Biotechnologe Benedikt Seligmann nutzt die Natur als Inspiration und lässt Hefezellen pflanzliche Wirkstoffe produzieren. (Bildquelle: © Benedikt Seligmann)
Pflanzen sind eine wahre Schatzkammer an Wirkstoffen. Doch die herkömmliche Gewinnung geht oft mit einem Raubbau an der Umwelt einher. Benedikt Seligmann bringt daher Hefezellen bei, pflanzliche Wirkstoffe wie das Krebsmittel Camptothecin herzustellen – nachhaltig und effizient.
Im Interview erläutert der Forscher der Uni Hannover, wie ein gutes Zusammenspiel im Team hilft, die komplexen Synthesewege der Natur im Labor nachzuahmen. Dabei geht er auch darauf ein, wie bestimmte pflanzliche Wirkstoffe eine umweltschonendere Landwirtschaft ermöglichen können.
Pflanzenforschung.de: Sebastian Kneipp sagte einmal, die Natur sei die beste Apotheke. Stimmen Sie dem zu, Herr Seligmann?

Der Krebs-Wirkstoff Camptothecin wird bislang aus dem Chinesischen Glücksbaum gewonnen. Das ist jedoch weder effizient noch nachhaltig.
Bildquelle: © Benedikt Seligmann
Benedikt Seligmann: Definitiv! Wenn wir uns klar machen, wie viele wichtige Medikamente auf pflanzlichen Wirkstoffen basieren, wird das enorme Potenzial der Natur als Inspirationsquelle deutlich. Bekannte pharmakologische Wirkstoffe aus Pflanzen sind beispielsweise das schmerzlindernde Morphin aus Mohn, Artemisin gegen Malaria aus Einjährigem Beifuß und Salicylsäure. Dieser Stoff wurde in der Weidenrinde entdeckt und ist das Vorbild für die chemische Synthese des bekannten Schmerzmittels Aspirin.
Die Natur ist aber die beste Chemikerin. Die meisten Wirkstoffe sind hochkomplex und werden von den Pflanzen in komplizierten biochemischen Reaktionen hergestellt. Teilweise müssen diese pflanzlichen Wirkstoffe noch für medizinische Anwendungen optimiert werden, zum Beispiel um besser verträglich zu sein. Und einige Stoffe werden mittlerweile nicht mehr aus Pflanzen gewonnen, sondern synthetisch hergestellt – so wie das Aspirin.
Pflanzenforschung.de: Mit welchem pflanzlichen Wirkstoff beschäftigen Sie sich?
Benedikt Seligmann: Ich arbeite im Moment im LiMEDisc-Projekt. Darin beschäftige ich mich mit dem Wirkstoff Camptothecin. Dieser kann aus bestimmten Pflanzen wie dem Chinesischen Glücksbaum Camptotheca acuminata gewonnen werden. Nach einigen chemischen Modifikationen wird Camptothecin für die Behandlung bestimmter Tumore eingesetzt, da es das Wachstum von Tumorzellen hemmen kann.
Camptothecin
Camptothecin ist ein pflanzliches Alkaloid, dessen Derivate als sogenannte Cytostatika zur Wachstumshemmung von bösartigen Zellen in der Tumortherapie eingesetzt werden. Die Substanz wirkt als Topoisomerase-I-Inhibitor. Topoisomerase-I ist ein Enzym, das während der DNA-Replikation und Transkription die Überwindung von Spannungen in der DNA ermöglicht. Durch die Hemmung dieses Enzyms führt Camptothecin zur Stabilisierung des Topoisomerase-I-DNA-Komplexes, was letztlich den Tod von Krebszellen verursacht. Die Wirkstoffe werden zum Beispiel in der Behandlung von Eierstockkrebs, Darmkrebs und kleinzelligen Lungenkrebs eingesetzt.
Pflanzenforschung.de: Wenn Camptothecin bereits aus Pflanzen gewonnen wird, warum braucht es da weitere Forschung?
Benedikt Seligmann: Das hat mehrere Gründe. Zum einen wachsen Bäume relativ langsam und der Glücksbaum enthält auch nur geringe Mengen des Wirkstoffs. Die Gewinnung ist daher ineffizient. Zum anderen ist dieser Baum aufgrund des steigenden Bedarfs an diesen Medikamenten bereits eine bedrohte Art. Die Produktion ist weder nachhaltig noch zukunftsorientiert. Eine biotechnologische Gewinnung von Camptothecin in Mikroorganismen könnte eine sichere und nachhaltige Alternative schaffen.
Pflanzenforschung.de: Wie gehen Sie das an?
Benedikt Seligmann: Wir möchten Mikroorganismen beibringen, Camptothecin oder ähnliche Therapeutika zu produzieren. Dafür müssen wir zunächst verstehen, wie Pflanzen diese Wirkstoffe herstellen. Wir analysieren die beteiligten Gene und die Interaktionen im Syntheseweg. Das ist allerdings gar nicht so leicht.
Pflanzenforschung.de: Können Sie das bitte näher erklären?
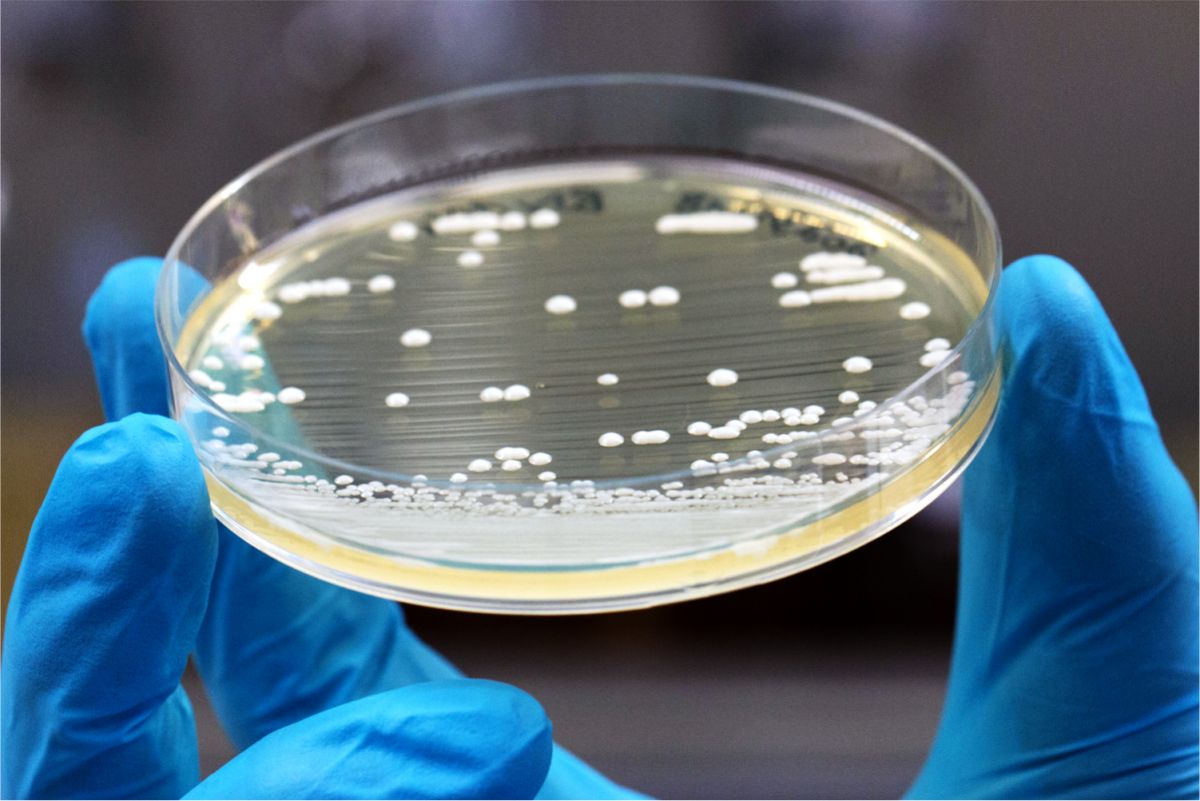
Die Forschenden bringen verschiedene Gene in Zellen der Bäckerhefe ein, damit diese lernen, den Wirkstoff Camptothecin herzustellen.
Bildquelle: © Jakob Franke
Benedikt Seligmann: Bei Pflanzen gibt es oft eine riesige Anzahl an Genen, die potenziell an der Synthese beteiligt sein können. Eine der größten Herausforderungen ist daher, aus der Vielzahl dieser Genkandidaten die richtigen auszuwählen. Der Syntheseweg von Camptothecin ist besonders komplex, was uns die Arbeit zusätzlich erschwert.
Bei der Überprüfung der Genkandidaten verwenden wir häufig Enzym-Assays. Sie zeigen uns, ob so ein Kandidat ein Substrat aus dem Syntheseweg tatsächlich in das nächste bekannte Produkt umsetzen kann. Leider sind diese Substrate oft teuer oder gar nicht käuflich erhältlich.
Pflanzenforschung.de: Und wie kommen Sie dann an diese Substrate?
Benedikt Seligmann: Wir entwickeln dafür unsere eigene Produktionsplattform mit Hefen. Die Hefekulturen sollen wichtige Zwischenprodukte aus dem pflanzlichen Biosyntheseweg herstellen. Dann kommen unsere Projektpartner von der University of British Columbia in Kanada ins Spiel. Die Gruppe um Thu-Thuy Dang setzt diese Stoffe in den Enzym-Assays ein und so können wir unbekannte Schritte im Biosyntheseweg Schritt für Schritt aufdecken. Wenn wir ein neues Gen für den Syntheseweg identifizieren, können wir es direkt in das Hefesystem einbauen. Dann stellen die Hefen das nächste Zwischenprodukt der Camptothecin-Synthese her. Und dann geht das so weiter, bis wir alle Gene dieses Biosyntheseweges in die Hefen übertragen und die Biosynthese aufgeklärt haben.

Hefekulturen produzieren bereits verschiedenste Vorstufen des pflanzlichen Wirkstoffs.
Bildquelle: © Jakob Franke
Pflanzenforschung.de: Wie weit ist die Hefe-Plattform gediehen?
Benedikt Seligmann: Wir konnten bereits einen Teil des pflanzlichen Synthesewegs in der Hefe nachbilden. Dazu haben wir zahlreiche Gene mithilfe der Genschere CRISPR/Cas9 in das Hefegenom übertragen und den Stoffwechsel der Hefen so gesteuert, dass sie mehr von den wichtigen Zwischenprodukten produzieren.
Zusätzlich haben wir diese Substanzen mit sogenannten Isotopen markiert. Damit lässt sich ihr Weg im Stoffwechsel verfolgen und analysieren. Wenn wir die markierten Zwischenprodukte in Pflanzen einbringen, können wir mit dieser chemischen Methode beispielsweise herausfinden, in welchen Pflanzenteilen welche Biosyntheseschritte stattfinden.
Pflanzenforschung.de: Das klingt nach einem komplexen und gut organisierten Zusammenspiel – sowohl in den Zellen als auch bei Ihnen im Projekt. Wie wichtig ist Teamwork Ihrer Meinung nach für den Erfolg dieser Arbeit?
Benedikt Seligmann: Aus meiner Sicht ist das Zusammenspiel ganz entscheidend. Bei der Forschung an komplexen Biosynthesewegen sind so viele verschiedene Ideen, Expertisen, Methoden und weitere Ressourcen erforderlich – ohne gute Zusammenarbeit wäre das kaum möglich. Mir gefällt das Motto „Mitstreiter statt Konkurrenten suchen“.
Pflanzenforschung.de: Kürzlich führte eine erfolgreiche Kollaboration zur Aufklärung eines anderen wichtigen Stoffwechselwegs, der in der Fachzeitschrift Science veröffentlicht wurde.

Um den Mechanismus eines Schritts der Gramin-Synthese untersuchen zu können, war ein spezieller Versuchsaufbau unter Ausschluss von Sauerstoff nötig.
Bildquelle: © Jakob Franke
Benedikt Seligmann: Ja genau. Für mich war es toll, Teil dieser Arbeit zu sein. Dabei ging es um die Biosynthese von Gramin. Gerste und andere Gräser produzieren dieses Alkaloid als Schutz vor Schädlingen. Aber Gerstensorten mit hohem Gramingehalt sind unverträglich für Wiederkäuer und daher als Futtermittel unbrauchbar.
Ein wesentlicher Schritt in der Biosynthese von Gramin war bislang eine „Black Box“, doch wir konnten das Rätsel lösen und das entscheidende Gen identifizieren.
Anschließend wollten wir auch verstehen, wie genau diese Schlüsselreaktion abläuft. Wir erstellten Hefestämme, die Gramin produzieren können, und untersuchten den Reaktionsmechanismus. Dabei konnten wir zum Beispiel zeigen, dass Sauerstoff für die Reaktion benötigt wird.
Pflanzenforschung.de: Welche Rolle spielt diese Art der „grünen Chemie“ Ihrer Ansicht nach für die Landwirtschaft?
Benedikt Seligmann: Unsere Erkenntnisse können nun genutzt werden, um die Graminsynthese gezielt zu steuern. So könnten Gerstensorten mit niedrigem Gramingehalt speziell zur Verwendung als Futtermitteln erzeugt werden oder umgekehrt: Sorten mit hohem Gramingehalt schützen sich selbständig gegen Schädlinge und das kann den Einsatz von chemischen Pflanzenschutzmitteln im Sinne einer umweltfreundlicheren Landwirtschaft deutlich senken. Gramin in den Pflanzen ist nämlich für uns Menschen unbedenklich und daher sind graminreiche Gerstensorten für unsere Ernährung kein Problem.
Pflanzenforschung.de: Haben Sie vielen Dank für das Gespräch und viel Erfolg für Ihre Vorhaben!
Im Text verlinkte Studie von Benedikt Seligmann:
- Kwan, B.D. et al. (2023) Leveraging synthetic biology and metabolic engineering to overcome obstacles in plant pathway elucidation. Current Opinion in Plant Biology, Volume 71, 102330. (2. Januar 2023) doi.org/10.1016/j.pbi.2022.102330
- Seligmann, B. et al. (2024). Chemical tools for unpicking plant specialised metabolic pathways. Current Opinion in Plant Biology, 80, 102554. (30. Mai 2024) doi.org/10.1016/j.pbi.2024.102554
- Dias S.L. et al. (2024) Biosynthesis of the allelopathic alkaloid gramine in barley by a cryptic oxidative rearrangement. Science, 383 (6690):1448-1454. (29. März 2024) doi: 10.1126/science.adk6112
Zum Weiterlesen auf Pflanzenforschung.de:
- Projekt LiMEDisc – Pflanzliches Krebsmedikament in Hefezellen herstellen
- „Geheimer“ Gencluster für die Selbstverteidigung – Gramin-Synthese in Gerste aufgeklärt
- Gerste-Giftstoff Gramin: Hoffnung für „Grüne Chemie“?
Titelbild: Der Biotechnologe Benedikt Seligmann nutzt die Natur als Inspiration und lässt Hefezellen pflanzliche Wirkstoffe produzieren. (Bildquelle: © Benedikt Seligmann)
